南湖新闻网讯(通讯员 刘通)近日,华中农业大学生命科学技术学院益生菌智造创新团队联合信息学院郑金水副教授在抗性基因传播方面的研究成果以“Enrofloxacin-induced transfer of multiple-antibiotic resistance genes and emergence of novel resistant bacteria in red swamp crayfish guts and pond sediments ”为题在Journal of Hazardous Materials上发表。本研究揭示了在抗生素压力下抗性基因(ARGs)的选择性扩增和传递以及ARGs与宿主细菌的相关性,并基于肠道和沉积物中的微生物群的宏基因组序列重建了新的多重耐药细菌基因组。
抗生素耐药基因(ARGs)可以从环境微生物转移到人类病原微生物,从而导致细菌感染治疗失败,特别是对多种抗生素具有耐药性的致病菌感染是死亡率的重要原因。水产养殖系统因为与水、沉积物和其他生态系统有着广泛的联系,抗生素在其的应用为耐药性的传播提供了一个广泛的环境途径。然而,在抗生素暴露的水产养殖系统中,ARGs的来源、历时变化和流动性仍然不清楚。本研究以小龙虾养殖为模型,分析了人工给药后(第三代喹诺酮类药物恩诺沙星)(1)小龙虾肠道和底泥各种ARG的时间变化,(2)小龙虾肠道和沉积物中细菌之间ARG转移的机制,(3)ARG与宿主细菌之间的相互作用,以确定耐药基因偏爱的细菌。
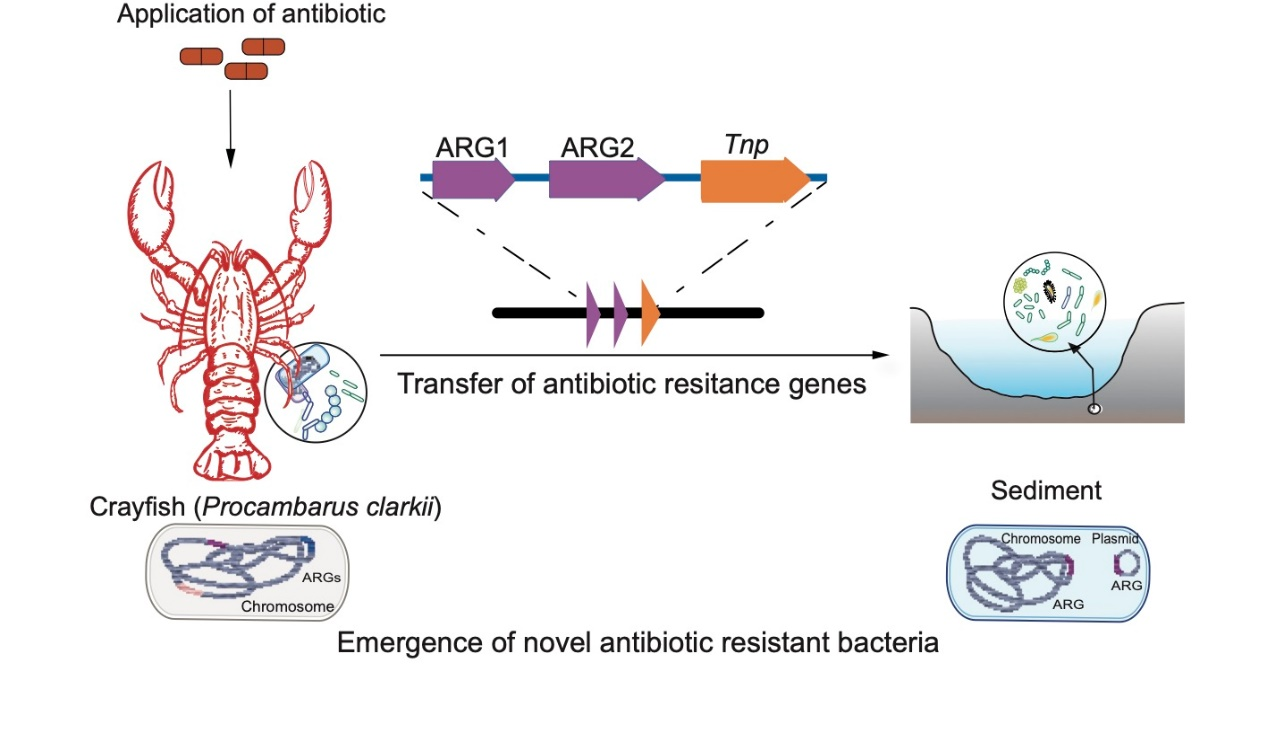
研究结果表明,恩诺沙星的应用不仅增加了喹诺酮类耐药ARGs的相对丰度,而且促进了对其他抗生素耐药ARGs的出现。此外,抗生素的应用诱导ARGs通过水平基因转移(HGT)在小龙虾肠道细菌和沉积物细菌中传播。值得注意的是,在抗生素压力下,转座酶介导的重组是ARGs转移的主要驱动因素。肠杆菌科可能是自然界中一个流动的ARG库,汇集了不同来源的ARG。研究还表明,恩诺沙星的应用诱导了一些携带多种ARGs的新型抗生素耐药物种。这些携带ARGs的细菌对水生动物和环境的污染值得高度关注。该研究强调了抗生素应用引起的ARG通过HGT在养殖环境中传播的风险。研究结果可为抗生素耐药性管理提供参考。
生命科学技术学院博士研究生金雪霞为论文第一作者,彭楠教授、郑金水教授为通讯作者。同时课题组刘思真、刘通等研究生参与了研究。本研究得到了湖北洪山实验室重大项目和生科院龙云计划等支持。
