南湖新闻网讯(通讯员:朱立)12月2日,湖北洪山实验室、生命科学技术学院徐曙彤教授课题组在Nature Communications在线发表题为“Structuralinsights into mechanism and specificity of the plant proteinO-fucosyltransferase SPINDLY”的论文。该研究综合运用结构生物学和生物化学等多学科手段,全面阐释了植物新型蛋白质岩藻糖基转移酶SPY特异性利用GDP-fucose作为糖基供体,催化DELLA等定位于核质中的蛋白质底物发生O-连接岩藻糖基化修饰的分子基础。
综合运用结构生物学和生物化学等多学科手段,全面阐释植物新型蛋白质岩藻糖基转移酶SPY发挥功能的分子机制
蛋白质的O-连接糖基化是实现蛋白质功能多样化、动态地调节胞内信号整合和细胞生理状态的关键机制。研究表明异常的蛋白质O-连接糖基化与人类的多种疾病(糖尿病、多种神经退行性疾病和癌症等)以及植物的许多发育障碍有关。植物SPINDLY (SPY) 蛋白在植物发育过程中发挥着多效性作用,包括生物钟调控、植物激素细胞分裂素信号转导、植物构型、根系发育、非生物和生物胁迫等。SPY为糖基转移酶GT41家族成员,尽管其与人源N-乙酰氨基葡萄糖转移酶OGT的氨基酸序列相似性较高,研究表明SPY是一种作用于核质蛋白的新型O-连接岩藻糖基转移酶,可特异性地催化赤霉素信号转导关键转录因子DELLA以及生物钟核心元件PRR5并调控这些蛋白的功能。SPY同源蛋白广泛存在于许多生命物种,包括原核生物、原生生物、藻类和所有植物,这表明SPY催化蛋白发生O-连接岩藻糖基修饰是一种广泛存在的调控胞内蛋白功能的方式。然而,SPY如何特异性识别糖基供体GDP-fucose以及被修饰的蛋白底物,以及如何催化fucose转移的分子机制尚不清楚。
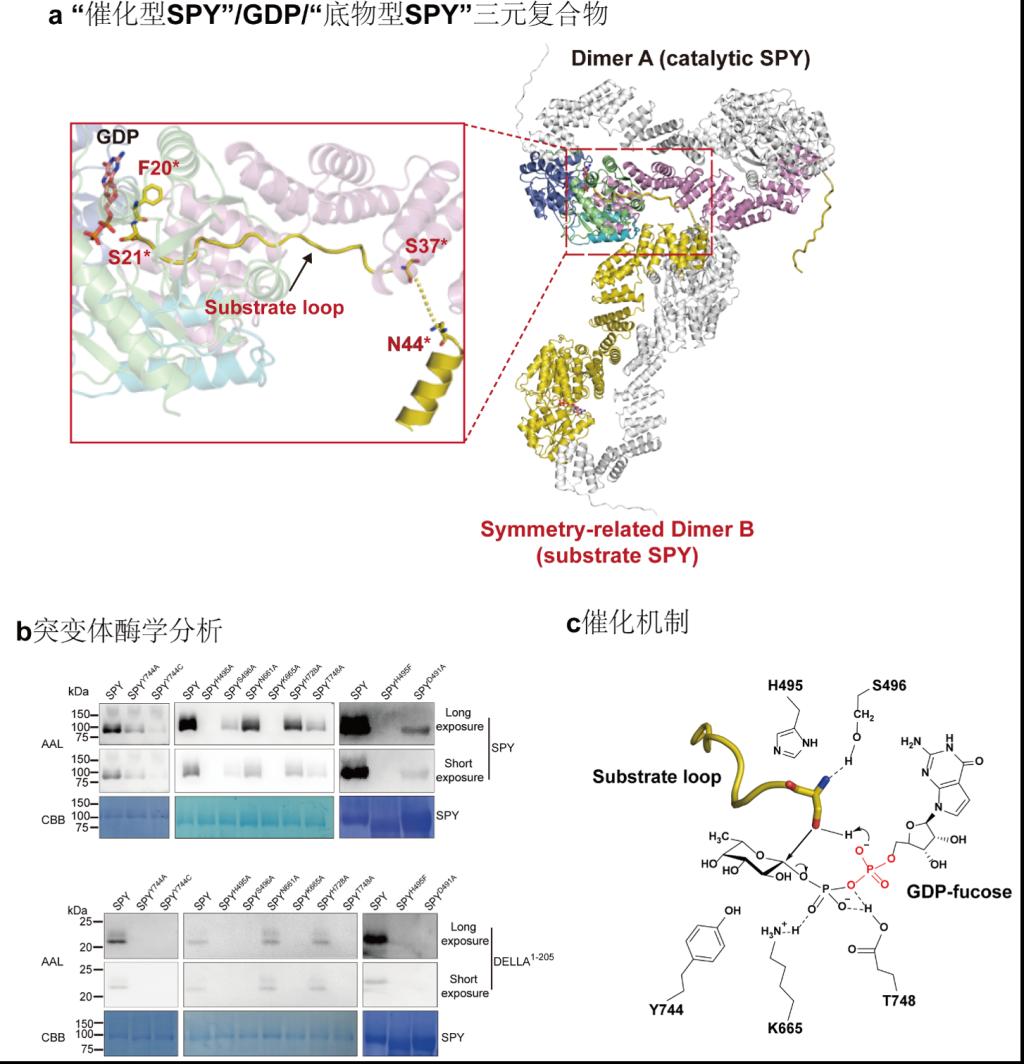
徐曙彤教授课题组解析了全长的拟南芥SPY与GDP复合物的晶体结构,分辨率为2.85Å。研究者在晶格中意外捕获了由对称相关分子构成的 “催化型SPY”/GDP/“底物型SPY”三元复合物构象,首次观察到完整的GT41家族酶与蛋白底物的结合模式。结合生物化学实验分析,研究者阐释了SPY的酶活调控机制;揭示了SPY识别糖基供体和蛋白底物的机理;阐明了SPY独特的酶学催化反应机制;同时为GT41家族成员特异性选择糖基供体提供理论依据。
生命科学技术学院博士研究生朱立与硕士研究生韦熹婷为论文共同第一作者,徐曙彤教授为通讯作者。该课题组多名博士和硕士参与了研究。本研究得到了国家重点研发计划、国家自然科学基金、学校自主创新基金等项目支持。
