近日,我校作物遗传改良国家重点实验室周道绣课题组首次在真核生物中报道了组蛋白去乙酰化酶对核糖体蛋白乙酰化修饰的调控及其功能的影响。该研究将蛋白的赖氨酸乙酰化修饰调控从转录水平扩展到蛋白质翻译水平,拓展和深化了人们对于表观调控机制的认知。
细胞中蛋白质功能的精细调控对于生物生长和发育至关重要,其中蛋白质的乙酰化、磷酸化等翻译后修饰是一种可逆、迅速且经济节约的调控方式。赖氨酸乙酰化(Kac)是一种以乙酰辅酶A为供体的蛋白质翻译后修饰。华中农业大学作物遗传改良国家重点实验室周道绣课题组基于质谱的蛋白质组学数据发现,乙酰化修饰不仅仅发生在组蛋白上,而且也广泛存在于细胞质中具有多种功能的代谢酶、转录因子及核糖体蛋白等非组蛋白上。该课题组之前解析了组蛋白去乙酰化酶(Histone deacetylase, HDAC)特异去除细胞质代谢酶和转录因子乙酰化修饰的作用机制。然而,核糖体蛋白是否也受组蛋白(去)乙酰化酶的调控以及乙酰化修饰对核糖体蛋白的调控功能还不是十分清楚。
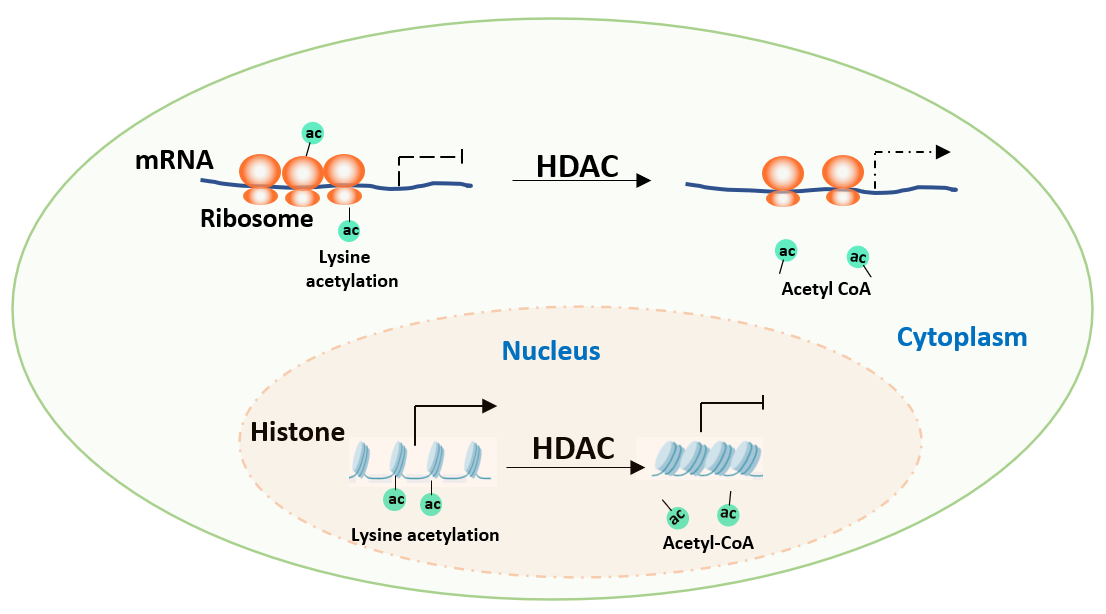
图1. HDAC对组蛋白以及核糖体蛋白乙酰化修饰的调控
本研究中,作者首先对水稻中3个细胞质定位的组蛋白去乙酰化酶HDA705、 HDA706和 HDA714突变体进行了全蛋白组乙酰化修饰谱定量分析,发现组蛋白去乙酰化酶HDA714是水稻非组蛋白乙酰化的主要调控因子,该基因突变后导致大量非组蛋白乙酰化修饰水平上升,其中包括参与翻译过程的核糖体蛋白及翻译因子。
乙酰辅酶A不仅仅是乙酰化酶的底物,而且也是非常重要的中间能量代谢产物,蛋白质乙酰化可能反应了细胞内能量代谢水平。HDAC调控的组蛋白代谢和核糖体乙酰化揭示了植物蛋白能量代谢在协调基因表达和翻译中的功能。生化实验进一步表明水稻组蛋白去乙酰化酶HDA714可以特异地去除核糖体蛋白赖氨酸上的乙酰化修饰。
hda714翻译组学分析表明核糖体蛋白的乙酰化修饰可以促进核糖体与mRNA的结合,对蛋白的翻译效率进行调控。该研究将蛋白的赖氨酸乙酰化修饰调控从转录水平扩展到蛋白质翻译水平,拓展和深化了人们对于表观调控机制的认知,对非组蛋白乙酰化功能的后续研究具有指导意义。
