南湖新闻网讯(通讯员 曾志锋)5月19日,《Cell Host & Microbe》以Article形式在线发表了我校农业微生物国家重点实验室、生命科学技术学院韩文元课题组解析新型Argonaute(Ago)系统免疫功能的最新研究成果。成果论文以“A short prokaryotic Argonaute activates membrane effector to confer antiviral defense”为题,报道了一种古菌Ago蛋白在识别病毒入侵后激活细胞膜上的毒性效应蛋白,通过引发细胞膜去极性化杀死被感染的细胞,从而抑制病毒增殖并为细胞群体提供免疫保护。这种免疫策略被称为流产感染(abortive infection),为多种免疫系统采用,而本研究则首次发现了原核Ago系统通过介导流产感染抵御病毒入侵。
微生物与病毒间的斗争与共同进化已经持续几十亿年。这种斗争迫使微生物进化出了多种免疫系统来抵御病毒的入侵。例如,大家较为熟知的CRISPR-Cas系统通过识别并降解入侵病毒的DNA提供免疫保护,而Ago也被认为是通过识别、切割靶标核酸发挥功能。Ago在真核生物中也广泛存在。真核Ago结合一小段RNA作为向导,在其引导下特异性识别并切割靶RNA,参与抵御病毒和转座子的入侵、基因表达调控等功能。原核Ago则往往通过DNA介导的DNA切割发挥免疫功能。生物信息学分析预测了一类短型、缺失核酸酶活性的原核Ago蛋白。这类Ago约占全部原核Ago的一半,却长期以来缺乏功能解析。
研究人员在冰岛硫化叶菌(Sulfolobus islandicus)中发现了编码短Ago蛋白的保守基因簇,该基因簇另外还编码一个可能的转录调控因子(AgaR)与两个未知功能的蛋白(Aga1与Aga2),预示它们可能组成免疫系统(SiAgo system)协同发挥作用。研究人员在不含该基因簇的菌株中表达了Ago、Aga1与Aga2,然后分析表达菌株对病毒入侵的响应。结果显示,SiAgo系统能够同时抑制病毒增殖与菌株生长,被感染的细胞快速出现了细胞膜去极性化的现象,这说明SiAgo系统通过介导流产感染抵御病毒入侵。
通过一系列遗传学、生物化学和结构生物学分析,韩文元课题组详细解析了Ago、Aga1与Aga2的功能(图1)。Ago和Aga1组成稳定的二元复合体,且具有核酸片段介导的特异性识别互补核酸的能力。Aga2是一个跨膜蛋白,作为毒性因子发挥功能,在过量表达时能够导致细胞膜去极性化。Aga2特异性结合磷脂酸和磷脂酰肌醇磷酸,这种特性与动物细胞中介导程序性细胞死亡的多种因子相似,反映了古菌与动物细胞自杀机制的保守性。另外,Ago-Aga1复合体直接与Aga2相互作用,且在病毒入侵后更多地被招募到细胞膜上。依据上述结果,研究人员提出了SiAgo系统的工作模型:Ago-Aga1复合体通过核酸识别感知病毒入侵,通过直接互作激活Aga2介导细胞膜去极性化,从而杀死被感染的细胞。
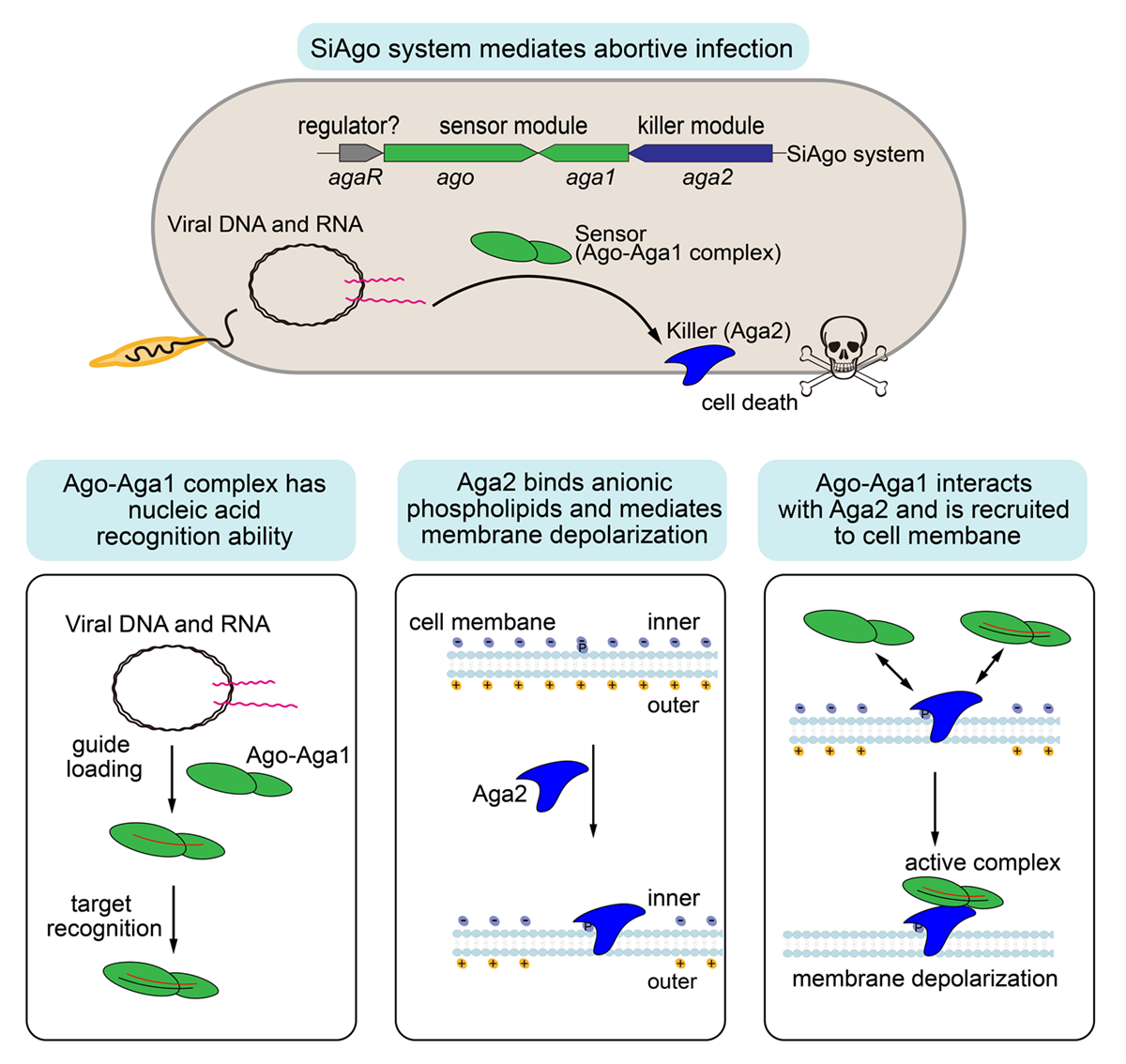
SiAgo系统介导流产感染及各组分的功能
本研究揭示了一种新型免疫模式:丧失了核酸酶活性的Ago蛋白仍然保持核酸特异性识别的能力,因而可以感知病毒的入侵,然后激活相关的效应蛋白,通过流产感染提供免疫保护。越来越多的证据表明,这种免疫模式广泛存在于Ago与CRISPR-Cas两类特异性核酸识别系统中。
生命科学技术学院博士研究生曾志锋为论文第一作者,韩文元教授为通讯作者。该课题组多名硕士生、本科生参与了研究。山东大学佘群新教授,美国伊利诺伊大学厄巴纳-香槟分校Rachel Whitaker教授、张昌毅博士,丹麦哥本哈根大学Rafael Pinilla-Redondo博士、Shiraz Shah博士,作物遗传改良国家重点实验室赵芬博士、王晨博士也参与了部分研究工作。本研究得到了国家自然科学基金、国家重点研发计划、洪山实验室基金等项目的支持。
