近日,我校动物科学技术学院、动物医学院精准兽药创制与环境消减技术开发团队巧妙设计了具有级联光动力疗法和营养免疫疗法协同作用的精准纳米系统,以新型的抗菌机制高效抗生物被膜感染,相关成果以“Targeting and Arginine-driven Synergizing Photodynamic Therapy with Nutritional Immunotherapy Nanosystems for Combating MRSA Biofilms”为题发表在Science advances上。本研究以PCN-224为光动力平台,开发一种靶向耐甲氧西林金黄色葡萄球菌生物被膜的精氨酸驱动的光动力与营养免疫协同治疗的复合纳米系统,并系统研究了该复合纳米系统对生物被膜的杀伤活性及其作用机制。
耐甲氧西林金黄色葡萄球菌(MRSA)是一种重要的人兽共患病原菌。MRSA可以利用生物被膜逃避宿主免疫系统和抗菌药物的杀伤作用而导致顽固性感染,严重威胁人类健康,也给畜牧业造成了巨大的经济损失。常规抗菌药由于其非特异性分布和生物被膜屏障常常导致其疗效低下,并极易诱导细菌耐药性。因此,迫切需要开发具有高效抗生物被膜作用且不易诱导耐药性的新型治疗策略。
光动力疗法通过产生活性氧实现对细菌的非特异性杀伤且不易诱导细菌耐药性。为此,本研究巧妙设计了基于光动力触发的级联反应核壳复合纳米系统(Arg-PCN@Gel)。该纳米系统可以靶向MRSA的自溶素(atl)而高效黏附于生物被膜,并在MRSA感染部位高表达的金属基质酶的作用下释放内核Arg-PCN。在红光照射下,Arg-PCN@Gel可以通过级联反应产生ROS、RNOS等多种活性物质,并驱动精氨酸产生NO信号分子增强宿主免疫反应,协同预防和杀伤生物膜。复合纳米系统主要通过下调cidA、icaA、arsR、copZ、codY、ccpA等来抑制MRSA的精氨酸代谢系统、金属元素代谢、能量利用效率、双组分系统和EPS的合成,以防止生物膜产生。同时,利用NO高效破坏成熟的生物膜屏障,促进ROS和ONOO-渗透到生物膜中,破坏生物被膜内MRSA的细胞壁和细胞膜。在小鼠生物被膜感染模型中,Arg-PCN@Gel可以靶向生物被膜感染部位并持续停留15天。在治疗初期,复合纳米系统可诱导促炎因子TNF-α和iNOS的高表达,并驱动精氨酸产生大量NO以发挥抗菌效果;在治疗后期,逐渐积累的NO不仅可清除细菌,还可诱导了IL-4和Arg-1等抗炎因子的表达,利用精氨酸从促炎阶段转化为抗炎阶段来促进伤口愈合。本研究为细菌生物被膜感染的治疗提供了高效精准的协同替代治疗方案,为解决生物被膜的治疗难题提供潜在的策略。
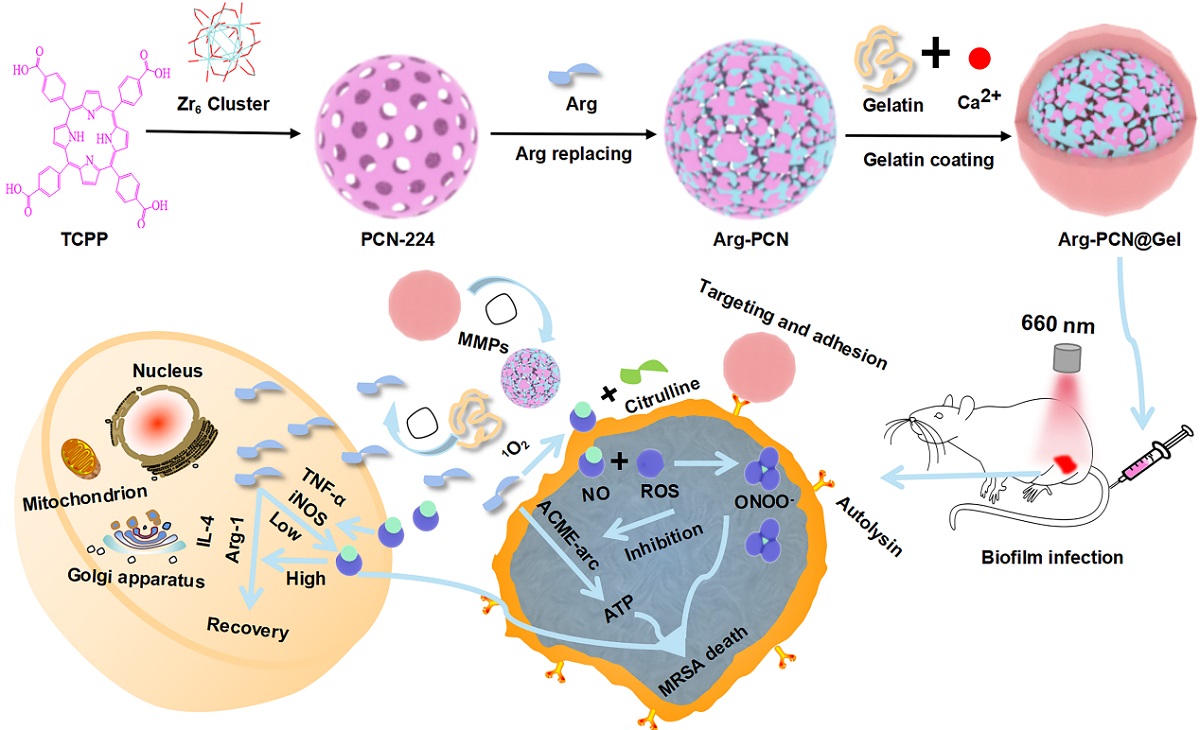
Arg-PCN@Gel的制备及其靶向协同光动力疗法和营养免疫疗法的示意图
我校动科动医学院博士研究生张傲雪为本论文第一作者,陈冬梅教授和谢书宇教授为共同通讯作者,课题组多位同学共同参与。该研究以农业微生物资源发掘与利用全国重点实验室、国家兽药残留基准实验室和非洲猪瘟等重大生猪疾病重点实验室为依托平台,得到了国家自然科学基金,国家重点研发计划和“华中农业大学自主科技创新基金-科技领军人才团队培育项目”专项资金的资助。
